近日,深圳大学化学与环境工程学院任祥忠教授团队在材料领域顶尖期刊《Advanced Functional Materials》(影响因子18.808,中科院JCR 1区,TOP期刊)发表了题为《Tumor Microenvironment Activated Chemodynamic-Photodynamic Therapy by Multistage Self-Assembly Engineered Protein Nanomedicine》的研究论文。深圳大学张秋红博士后和上海交通大学贺美娟博士为共同一作,深圳大学任祥忠教授和张俊民副教授、上海交通大学王悍教授、南洋理工大学Yanli Zhao教授为该论文共同通讯作者,深圳大学为第一作者单位和第一通讯单位。

纳米医学领域广泛报道的化学动力治疗、光动力治疗都是基于活性氧(ROS,如•OH, 1O2 等)的新型癌症治疗手段,然而开发一种可激活的ROS生成纳米体系以实现对正常组织副作用最小的高度特异性癌症治疗仍然具有挑战性。
在本研究中,我们基于多级自组装策略构建了一种在肿瘤微环境下选择性产生ROS的蛋白纳米药物GHBC。首先,基于交联和分子自组装,获得了酶GOx、HRP和光敏剂Ce6自组装纳米颗粒GHC,以及血清白蛋白BSA和Ce6自组装纳米颗粒BC。GHC表现出超高的GOx-HRP级联酶活性,而且GHC和BC均实现了疏水光敏剂Ce6的负载。接下来,基于纳米颗粒自组装,GHC通过还原敏感连接物被BC封装,形成最终的GHBC,这不仅避免了GOx-HRP级联酶暴露在正常组织中,还加重了光敏剂Ce6的聚集诱导猝灭效应、降低了皮肤的光毒性。更重要的是,一旦被瘤内还原微环境触发,GHBCNPs解体释放聚集效应,暴露GOx-HRP级联酶和恢复Ce6的光敏性,从而分解肿瘤内葡萄糖生成细胞毒性的•OH和响应外部激光照射产生1O2,实现肿瘤特异性化学动力学-光动力学联合治疗。这项研究工作为新型纳米药物设计和更精确的癌症治疗提供了新思路。
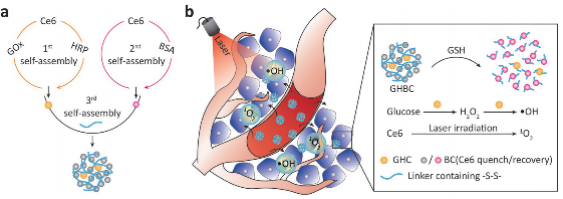
图1.GHBC纳米粒子合成及其治疗癌症示意图
该研究项目得到了国家自然科学基金、广东省自然科学基金和深圳市基础研究项目的资助。
论文链接:https://doi.org/10.1002/adfm.202112251.
