近日,深圳大学化学与环境工程学院任祥忠教授团队在期刊《Nature Communications》(影响因子17.694,中科院JCR 1区,TOP期刊)上发表了题为《Nanozyme-reinforced hydrogel as a H2O2-driven oxygenerator for enhancing prosthetic interface osseointegration in rheumatoid arthritis therapy》的论文。该团队博士后赵月为第一作者,任祥忠教授、新加坡南洋理工大学赵彦利教授、吉大二院骨科王金成和李祖浩教授为共同通讯作者。深圳大学为第一作者单位和通讯单位。

随着社会发展和人类生活水平的进步,健康问题越来越成为人们关注的焦点和热点。类风湿关节炎(Rheumatoid Arthritis,RA)是一种以侵蚀性关节滑膜炎为主要临床表现的慢性自身免疫疾病。最新流行病学调查显示,在我国大陆地区,RA发病率约为0.42%,且以每年0.7%的速率快速增长,是致残和造成劳动力丧失的主要原因之一。随着再生医学的不断发展,基于干细胞的RA疗法逐渐走进大众视野并受到医学界的广泛关注。与传统治疗方法相比,基于干细胞的治疗具有免疫源低、提取率高、微创取材、治疗过程简单等特点。尤其是间充质干细胞具有分化为成骨细胞和软骨细胞,修复损伤关节的能力;其免疫调节的作用还可以缓解关节炎症,减少滑膜增生。
虽然干细胞为基础的治疗在风湿性关节炎的治疗中具有优势,但该方法的广泛应用仍面临一些不可逾越的障碍。首先,在RA病理环境中,由于关节内炎症细胞的浸润、滑膜组织的增生以及新血管的生成,关节内形成乏氧微环境。与此同时,低氧诱导因子-1水平上调,并促使滑膜组织分泌大量的炎胞因子。这些炎症因子构成RA的炎症微环境不利于移植干细胞的存活和分化。此外,RA患者由于长期处于氧化应激状态,机体对活性氧自由基(Reactive Oxygen Species,ROS)的清除能力下降,大量产生和堆积的ROS会与移植干细胞中的DNA、蛋白质以及脂质发生反应,进而引起移植干细胞存活率降低,极大地限制了干细胞治疗RA的效果。针对于以上干细胞治疗RA的现状,亟待开发一种高效和生物相容性好的干细胞自我保护的载体,来增加干细胞的成活和分化能力,从而使干细胞在RA病理环境中发挥最佳的治疗效果。
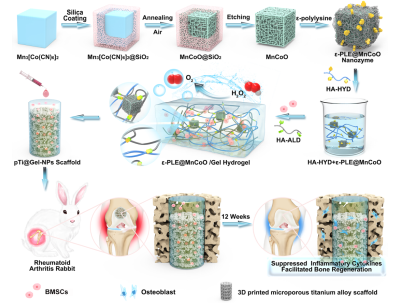
图1. 仿生智能水凝胶干细胞支架制备及其用于辅助干细胞治疗RA示意图
水凝胶是由聚合物分子交联而成的三维网络结构,在介导干细胞相关治疗的研究中有着巨大潜力和应用前景。作为一种含水量极高、质地柔软的高分子材料,水凝胶具有高度可调的力学性能、良好的生物相容性、以及易功能化等特点。在结构上,水凝胶与纤维胶原蛋白、肽聚糖等生物大分子和水组成的细胞外基质十分相似,比任何其他种类的合成生物材料更能模拟自然的活体组织。因此,水凝胶被广泛应用于干细胞载体中。与单纯干细胞移植相比,水凝胶输送干细胞进行移植治疗不仅可以利用凝胶材料本身的特性改善病灶微环境,还能有效提高移植细胞的运输率、滞留率和存活率,并对体内移植细胞的增殖、分化及与宿主的整合发挥调控作用。
基于以上考虑,该团队以动物骨基质有机-无机杂化结构为启发,构建了一种新型的仿生智能水凝胶干细胞支架用于辅助干细胞治疗RA。该支架材料由纳米复合水凝胶以及三维打印多孔金属支架(3D printing porous metal scaffolds,3DPMS)复合而成。该软硬结合的支架充分模拟骨骼组织无机-有机复合的形貌特征。当其作为骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)移植过程中的载体时,3DPMS作为力学支撑的模板,还可以根据患者需求个性化地重建大规模骨缺损,并且其微孔结构的设计对于维持成骨细胞形态并促进成骨细胞的粘附、增殖以及分化具有积极作用。此外,纳米复合水凝胶为干细胞的存活和功能提供有利的三维微环境。体内动物实验证明复合支架具有促进干细胞的骨修复和降低炎症等作用。这种改善RA病理微环境的干细胞载体为实现RA治疗提供新思路,有望进一步拓宽纳米复合水凝胶材料在生物医学领域中的应用,同时符合现阶段我国社会经济发展以及满足人民群众对健康生活的迫切需求。
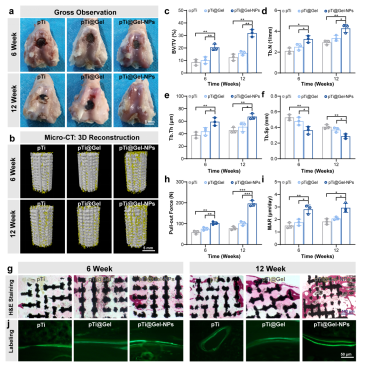
图2. 纳米酶增强水凝胶促进骨整合
该研究得到国家自然科学基金、博士后派出计划等项目的联合资助。
原文链接:https://www.nature.com/articles/s41467-022-34481-5
